Home » Leistungen » Analytik » Pharma » Stabilitätsprüfungen
Ein fundamentaler Aspekt zur Gewährleistung der Patientensicherheit und der Qualität eines Arzneimittels ist die Durchführung von Stabilitätsstudien und Stresstests. Die Stabilität sowie die Lagerbedingungen und Haltbarkeit eines Wirkstoffs bzw. Fertigarzneimittels sind entscheidende Parameter bei der Entwicklung eines neuen Arzneimittels – von der Zulassung bis zur Vermarktung. Um Sie bei diesem umfangreichen Prozess zu unterstützen, bieten wir Ihnen das komplette Leistungsspektrum: Von der Einlagerung Ihres Produkts über die Analytik, die Planung, Entwicklung und Validierung analytischer Prüfmethoden, bis hin zur vollständigen Dokumentation und Auswertung der erhobenen Daten.
Durch unsere Vielzahl an cGMP qualifizierten Klimaschränken können wir verschiedenste Stabilitätsstudien gemäß den in den ICH Guidelines (ICH Q1A/Q1F/VICH GL3) beschriebenen Lagerkonditionen, und damit angelehnt an die von der WHO definierten Klimazonen (I-IV), durchführen. Unser Spektrum umfasst:
Die Prüfintervalle für das jeweilige Studiendesign können individuell angepasst werden, orientieren sich jedoch in der Regel an der Guideline und den darin festgelegten Mindestlaufzeiten der für eine Einreichung erforderlichen Lagerzeiten. Stabilitätsprüfungen, im Rahmen der Maximalhaltbarkeit auf bis zu fünf Jahren, sind ebenfalls bei uns möglich.
Darüber hinaus bieten wir Ihnen ebenfalls die Möglichkeit zur Durchführung von Stresstests, um bereits frühzeitig Abbauprodukte zu identifizieren, Aussagen über die Stabilität eines Stoffes machen zu können und geeignete Verfahren der Analyse zu treffen. Neben der Prüfung durch thermische Stressung, durch erhöhte Temperatur (beispielsweise 60°C) oder erhöhter Feuchtigkeit (beispielsweise 90% rH), können wir Produkte ebenfalls auf die in der ICH Q1B beschriebene Photostabilität testen.
Auch hier können die Bedingungen individuell festgelegt werden, orientieren sich aber in der Regel an den Guidelines.
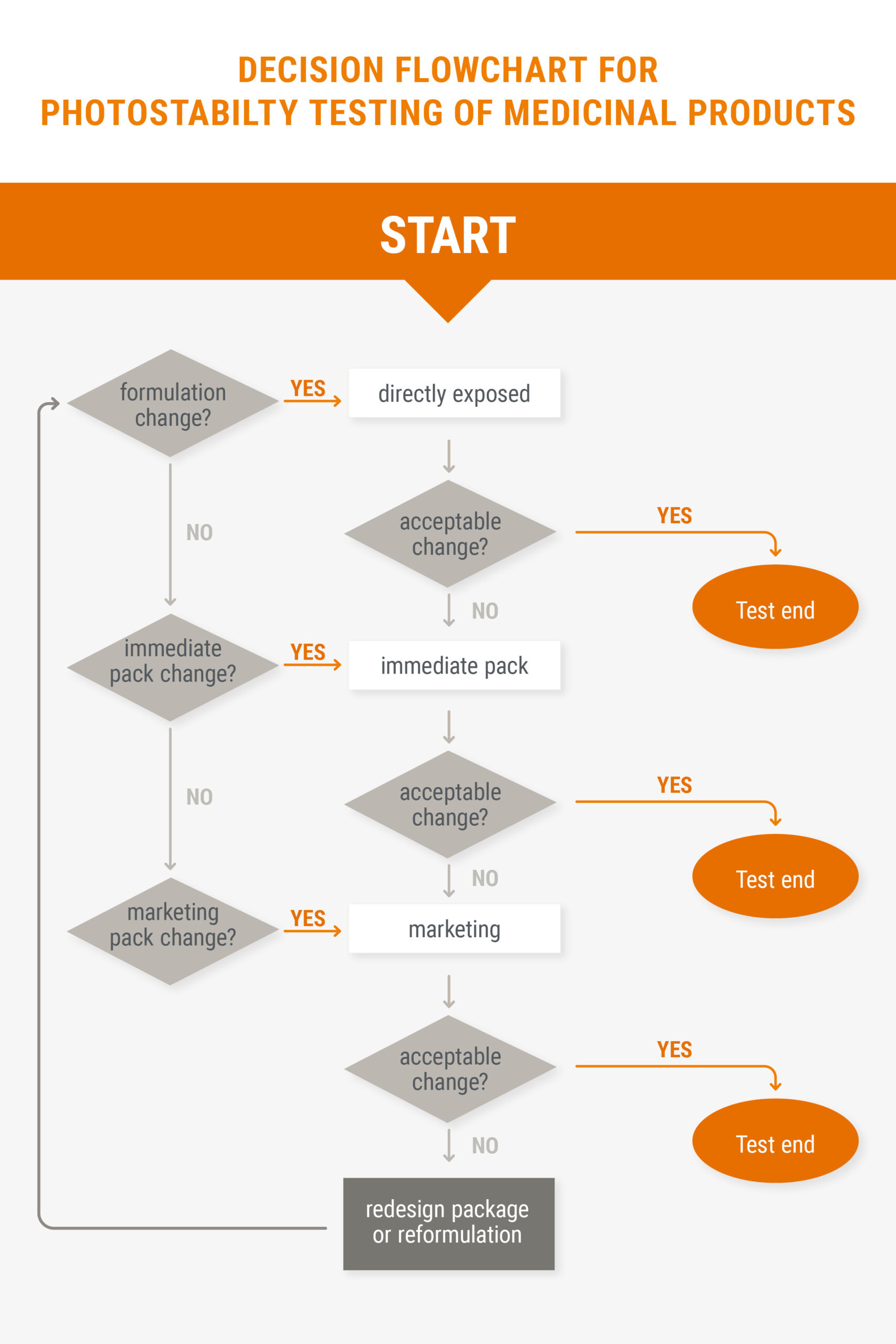
Abbildung: Flowchart für die Photostabilitätsmessungen von pharmazeutischen Produkten aus der ICH Q1B guideline
Um eine Aussage über die Auswirkungen kurzzeitiger Temperaturschwankungen auf die Stabilität eines Arzneistoffes zu treffen, können sogenannte Schaukelstudien durchgeführt werden. Hierbei wird der Arzneistoff kurzfristig bei niedrigeren Temperaturen (bis zu -20°C) für z.B. 2 Tage und anschließend kurzfristig bei höheren Temperaturen (bis zu 40°C) gelagert.
Da es sich bei Stabilitätsstudien um langjährige Projekte handelt, kann zur schnelleren Bewertung eine Datenanalyse im Rahmen des Accelerated Stability Assessment Program (ASAP) erfolgen. Hierzu werden repräsentative Chargen für einen Zeitraum von bis zu einem Monat extremeren Temperatur-/ (10°C-70°C) und Feuchtebedingungen (10%-90% rH) ausgesetzt und anschließend analysiert. Durch statistische Berechnung der dabei erhobenen Daten, unter anderem auf Basis der Arrhenius Gleichung, können frühzeitiger Informationen zur Lagerstabilität, kritischen Parametern und der voraussichtlichen Haltbarkeit getroffen werden. Dies ersetzt nicht die für die Einreichung notwendigen Daten einer Stabilitätsstudie, ermöglicht es aber in kürzerer Zeit, valide Daten zu Critical Quality Attributes (CQA) eines Arzneistoffs zu erhalten und zur Konzeptionierung einer Quality by Design (QbD) beizutragen.
Entsprechend der Eigenschaften Ihres Produkts, sei es ein Wirkstoff oder das Fertigprodukt, von fest bis flüssig, können wir Ihnen ein breites Analytik-Portfolio anbieten. Bei der Konzeptionierung der Analytik stehen wir Ihnen gerne zur Verfügung.
Falls Sie die gewünschten Lagerbedingungen nicht in unserem Standardportfolio finden, kontaktieren Sie uns gerne und wir prüfen weitere Optionen für Sie.
Profitieren Sie von unserer langjährigen Erfahrung bei der Durchführung von Stabilitätsstudien und unserem Know-how über ein breites Spektrum an Analytik hinweg – Sprechen Sie uns gerne an!
